La perte de vision chez les personnes âgées est un problème de santé majeur : environ une personne sur trois aura une maladie limitant la vision d’ici l’âge de 65 ans. La dégénérescence maculaire liée à l’âge (DMLA) est la cause la plus fréquente de cécité dans le monde développé. En Europe, environ 25 % des personnes âgées de 60 ans ou plus sont atteintes de DMLA. La forme «sèche» est relativement courante chez les personnes de plus de 65 ans et n’entraîne généralement qu’une perte de vision. Cependant, environ 15 % des patients atteints de DMLA sèche développent une forme plus grave de la maladie, la DMLA exsudative ou exAMD, qui peut entraîner une perte de vision rapide et permanente. Heureusement, il existe des traitements qui peuvent ralentir davantage la perte de vision. Bien qu’il n’y ait pas de traitement préventif disponible pour le moment, il est exploré dans des essais cliniques. Ainsi, la préparation du développement de l’exAMD peut représenter une fenêtre critique pour cibler les innovations thérapeutiques : pouvons-nous prédire quels patients évolueront vers l’exAMD et aider à prévenir la perte de vision avant qu’elle ne se produise ?
Dans nos travaux les plus récents, publiés dans Nature Medicine, nous avons collaboré avec Moorfields Eye Hospital et Google Health pour organiser un ensemble de données d’images rétiniennes, former un système d’intelligence artificielle (IA) capable de prédire la progression de l’exAMD et réaliser une étude évaluant notre modèle contre des cliniciens experts. Nous démontrons que notre système peut être plus performant que les cliniciens pour prédire si un œil se convertira en exAMD au cours des six prochains mois. Enfin, nous explorons le potentiel d’application clinique de notre système. Notre contribution met en évidence le potentiel d’utilisation de l’IA dans les études préventives de maladies telles que l’exAMD.
Jeu de données AMD pour Moorfields Eye Hospital
Nous avons utilisé un ensemble de données d’examens rétiniens anonymisés de patients de Moorfields atteints de DMLA ex dans un œil, qui risquent de développer une DMLA ex dans leur autre œil. Cela comprend 2 795 patients répartis sur sept sites différents de Moorfields à Londres, avec une représentation de tous les sexes, groupes d’âge et ethnies. Ces patients se rendent régulièrement à l’hôpital pour un traitement et subissent une tomographie optique 3D haute résolution (OCT) des deux yeux, à chaque visite. Il y a souvent un délai entre le moment où l’exAMD apparaît et le moment où elle est diagnostiquée et traitée. Pour résoudre ce problème, nous avons travaillé avec des experts de la rétine pour examiner tous les scans de chaque œil et sélectionner le scan lorsque le test exAMD est sorti pour la première fois.
Formation sur le système d’alerte précoce AMD
Notre système se compose de deux réseaux de neurones à convolution profonde qui prennent en entrée un balayage volumétrique de grande dimension, chaque balayage étant composé de 58 millions de pixels 3D (voxels). Dans nos précédents travaux, que nous poursuivons aujourd’hui en collaboration avec Google Health, nous avons développé un modèle capable de subdiviser ces scans oculaires en treize catégories anatomiques. Les données fragmentées ont été combinées avec l’examen brut et les deux ont été utilisées comme données d’entrée dans un modèle de prédiction, qui a été formé pour estimer le risque d’un patient de développer une exAMD dans son autre œil au cours des 6 prochains mois.
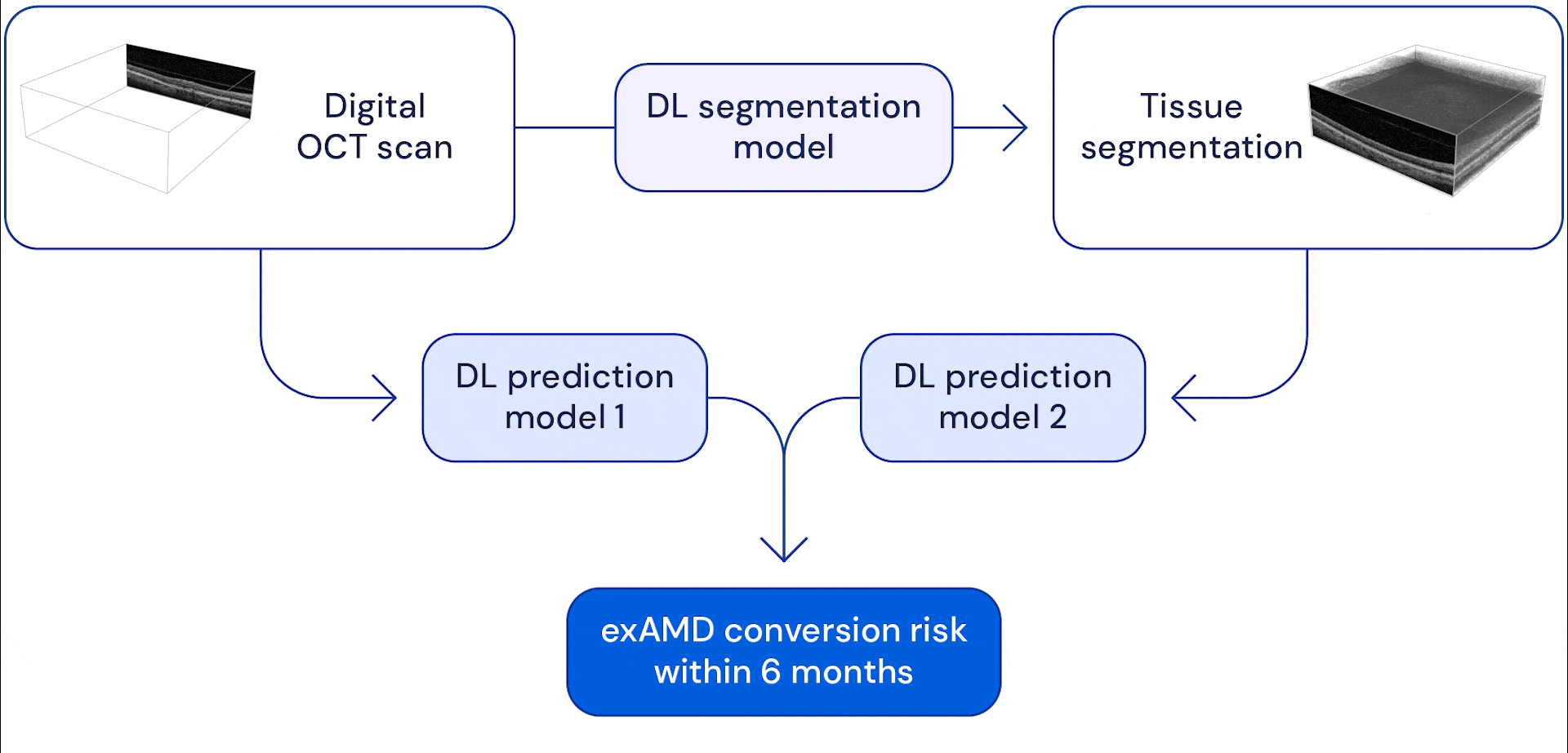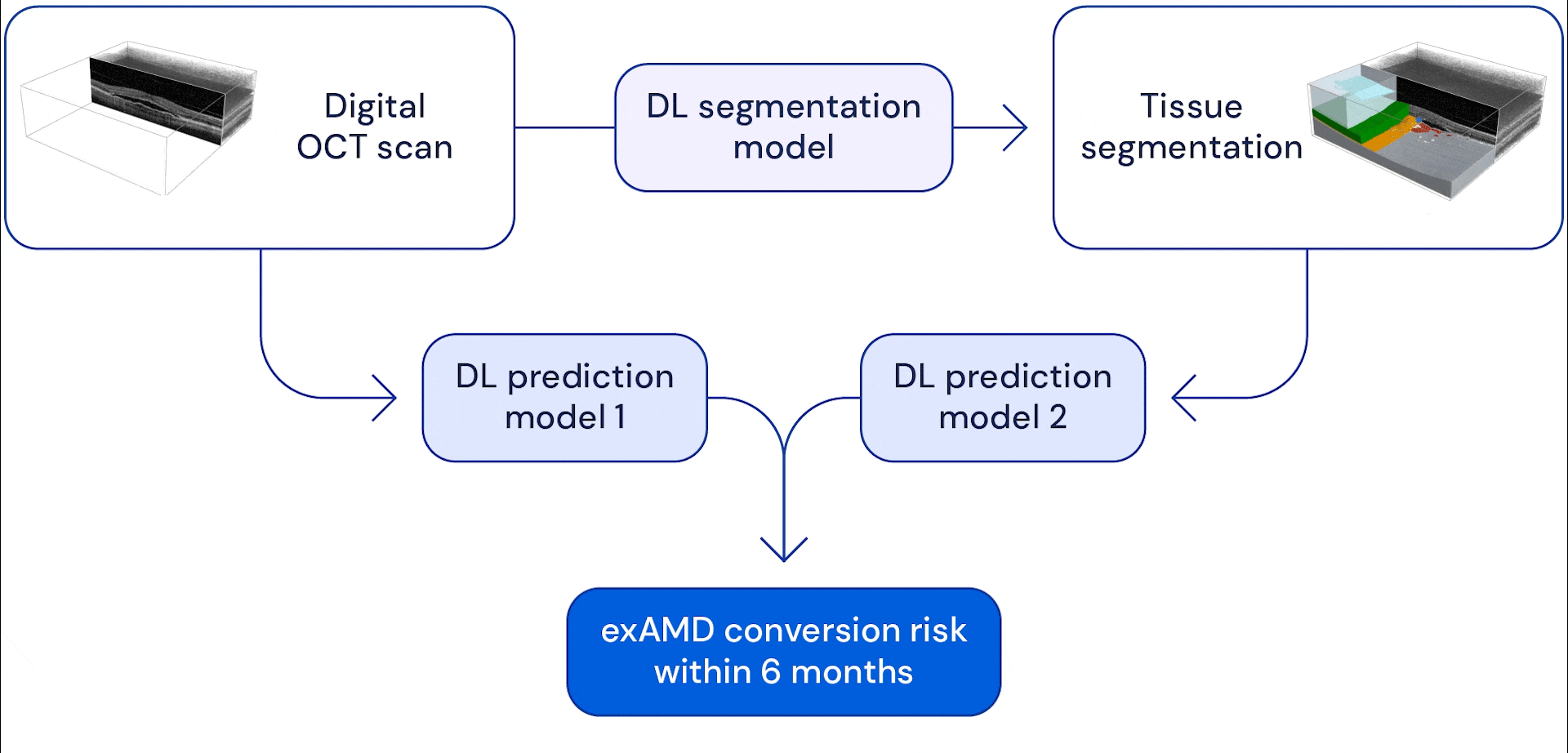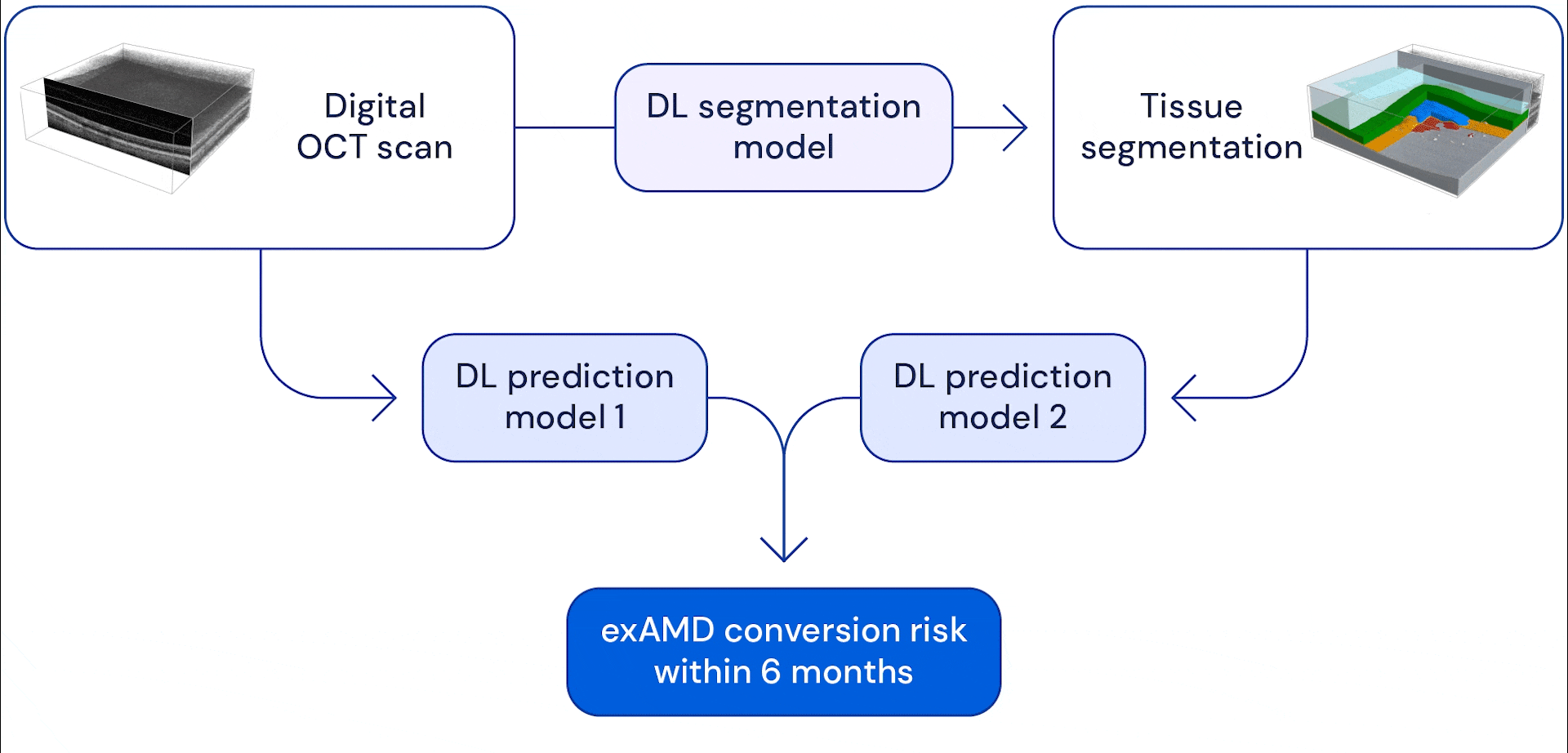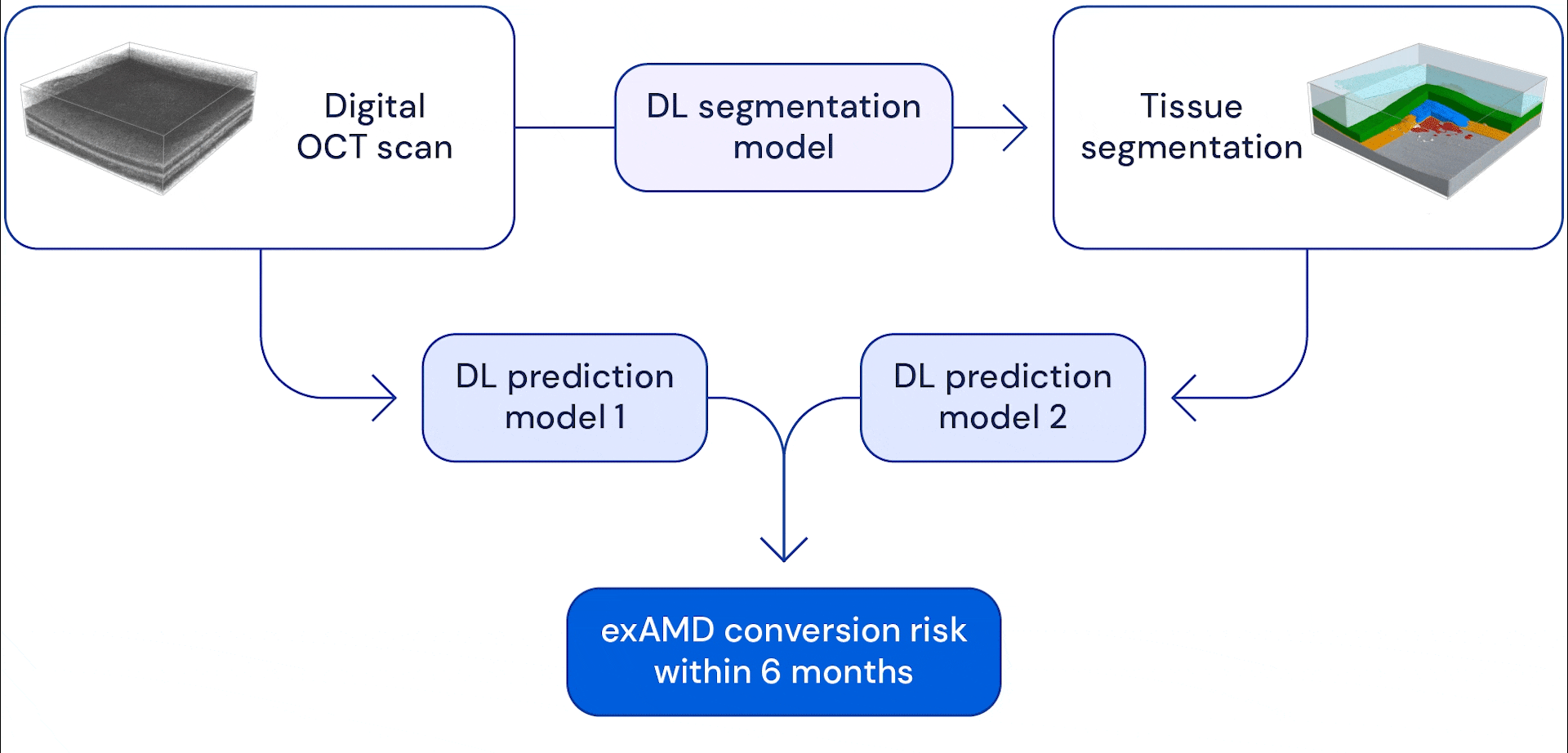
L’avantage du système en deux étapes est qu’il donne à l’IA différentes vues de balayage oculaire. La segmentation anatomique des images aide le système à apprendre à modéliser les risques en fonction des signes d’indicateurs anatomiques connus tels que les drusen (petits dépôts graisseux) ou la perte de l’épithélium pigmentaire rétinien (qui aide à nourrir et à protéger les autres couches de la rétine). Fournir des examens de la vue initiaux permet au modèle d’apprendre à repérer d’autres changements subtils qui pourraient devenir des facteurs de risque potentiels. En fin de compte, le système combine les informations qu’il extrait de ces analyses pour prédire quand et si un œil s’appliquera à un examen exAMD dans les six prochains mois. Nous avons choisi cette fenêtre de temps pour permettre au système de prédire au moins deux intervalles de suivi à l’avance, en supposant une période de suivi maximale de 3 mois.
Norme d’expertise clinique pour prédire l’avenir
Il est important d’établir une norme de performance humaine experte pour comparer la performance de notre système avec les normes cliniques. Cependant, prédire l’exAMD n’est pas une tâche de routine pour les cliniciens, il n’est donc pas clair si cette tâche est réalisable. Pour étudier cela, nous avons mené une étude avec six experts de la rétine – trois ophtalmologistes et trois optométristes, chacun avec au moins dix ans d’expérience – pour prédire si un œil se convertirait en exAMD au cours des six prochains mois. Malgré la nouveauté de la tâche, les experts ont mieux réussi que le hasard, mais la tâche était difficile et il y avait un énorme écart entre leurs évaluations. Notre système a mieux performé que, et dans certains cas mieux que, les experts pour prédire la progression de l’exAMD, et en même temps a montré moins de variance en accord avec chaque expert, que les experts entre eux.
La DMLA est une maladie incroyablement complexe qui affecte profondément la vie de millions de personnes dans le monde. Avec ce travail, nous n’avons pas résolu AMD… mais je pense que nous venons d’ajouter une autre grosse pièce au puzzle.
Pierce Kane, scientifique médical à l’Institut national des droits de l’homme
Visualisez la progression de la maladie
Il se peut qu’il ne suffise pas que le système fasse simplement une prédiction : idéalement, les cliniciens pourraient également rechercher des informations concernant la base anatomique des prédictions, ce qui pourrait être d’une grande utilité pour une interprétation ultérieure (par exemple, pour concevoir des études ou envisager des traitements). Un avantage de notre système est qu’il divise automatiquement chaque scan en types de tissus connus. L’extraction de ces caractéristiques anatomiques et pathologiques fournit un moyen systématique de visualiser l’évolution de ces tissus au fil du temps. Les scores de risque présentés par notre système correspondent aux changements anatomiques au fil du temps et, ensemble, donnent une image plus riche de la transformation de l’exAMD.

Trop tard
Nous sommes enthousiasmés par la possibilité de soutenir les cliniciens et les chercheurs en développant des systèmes qui peuvent aider à détecter précocement les maladies rétiniennes et à éclairer la compréhension clinique de leur progression. Un système de prédiction tel que celui-ci peut être utilisé pour informer les intervalles de suivi appropriés afin de gérer efficacement les patients à haut risque. Notre travail s’appuie sur les premiers travaux prometteurs de développement de modèles prédictifs pour l’exAMD basés sur des images rétiniennes et des scans OCT. Depuis le début de notre collaboration avec Moorfields Eye Hospital en 2016, nous avons publié deux études prometteuses soulignant le potentiel de l’IA pour transformer les soins de santé rétiniens.
Cependant, nous savons qu’il reste beaucoup à faire – ce travail ne représente pas encore un produit pouvant être mis en œuvre dans la pratique clinique courante. Bien que notre modèle puisse faire de meilleures prédictions que les experts cliniques, de nombreux autres facteurs doivent être pris en compte pour que de tels régimes soient efficaces dans un cadre clinique. Bien que le modèle ait été formé et évalué sur une population représentative du plus grand hôpital ophtalmologique d’Europe, des travaux supplémentaires seraient nécessaires pour évaluer les performances dans le contexte de données démographiques très différentes. Une étude récente portant sur l’utilisation d’un système d’IA différent dans un contexte clinique n’a mis en évidence que certains des problèmes sociaux et techniques de ces systèmes dans la pratique. Un autre point difficile à traiter est que tout système de prédiction aura un certain taux de faux positifs : c’est-à-dire que lorsqu’un patient est atteint d’une maladie, ou devrait l’être, il n’est pas réellement là. Le compromis consistant à ajouter un système d’IA inexact à la boucle d’alerte précoce pourrait être inutilement coûteux pour les patients qui ne sont pas déjà à risque, et devrait être soigneusement pris en compte dans les études cliniques sur la manière dont ces systèmes peuvent être utilisés dans la pratique. Dans cet article, nous proposons deux points de fonctionnement pour le système afin d’équilibrer la sensibilité (une mesure de la précision avec laquelle une maladie est identifiée) et la spécificité (une mesure de la faiblesse du taux de faux positifs). Par exemple, à un réglage de 90 %, une sensibilité de 34 % est atteinte, ce qui signifie que le système a correctement identifié la progression dans un tiers des scans qui ont continué à progresser dans les 6 mois. Cela pourrait identifier un certain nombre de patients à haut risque avec une précision qui pourrait être suffisante pour informer les études de nouvelles stratégies de traitement susceptibles d’atténuer la perte de vision et d’améliorer les résultats pour les patients.
Nous tenons à remercier Moorfields Eye Hospital et les cliniciens qui ont aidé à coordonner les données et participé à notre étude standard. Veuillez consulter la feuille pour tous les remerciements et plus de détails sur le travail. De plus, nous avons ouvert le code modèle pour les recherches futures, disponible ici, et Moorfields rendra l’ensemble de données disponible via l’initiative de recherche maculaire de Ryan.
